Was in der Atomphysik das Element ist, ist in der Kernphysik das Nuklid.
Die Eigenschaften der Elemente werden fast ausschließlich durch die Anzahl und Anordnung der Elektronen bestimmt. Deshalb ist für die Einteilung der Atome in Elemente nur die elektrische Ladung des Atomkerns entscheidend. In der Kernphysik muss man weitergehen und auch die unterschiedlichen Isotope eines Elements deutlich unterscheiden. Bei manchen Kernen gibt es sogar verschiedene Zustände, die sich weder durch ihre Ladung noch durch ihre Massenzahl unterscheiden und dennoch verschiedene Eigenschaften haben. Auch solche Kerne werden manchmal als unterschiedliche Nuklide bezeichnet.
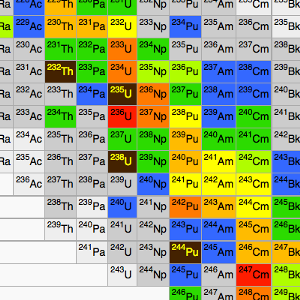
Ähnlich wie man Elemente im Periodensystem der Elemente nach ihren wichtigsten chemischen Eigenschaften zusammenstellt, kann man Nuklide in Nuklidkarten darstellen. Da es für jedes Element mehrere Nuklide gibt, sind Nuklidkarten viel umfangreicher als das Periodensystem der Elemente. Links sehen Sie einen Ausschnitt aus einer Nuklidkarte aus dem Wikipedia-Eintrag. Sortiert ist die Karte nach Anzahl von Protonen und Neutronen. Nuklide die übereinander dargestellt sind, sind Isotope des seben Elements. Nebeneinander werden Nuklide mit der selben Neutronenzahl dargestellt. Diagonal von links unten nach rechts oben finden sich Nuklide mit gleicher Massenzahl, also Isobare.
Die Bezeichnungen auf der Nuklidkarte sind die üblichen Notationen für Nuklide. 232Th bezeichnet ein Isotop des Elementes Thorium mit 232 Nukleonen (Kernteilchen). Aus einem Periodensystem kann man heraussuchen, dass Thorium 90 Protonen hat. Damit muss das Nuklid 232Th 232-90=142 Neutronen haben. Alle Nukide, die in der selben Zeile stehen, wie zum Beispiel 234U (gesprochen Uran-234) haben auch 142 Neutronen. Analog kann man ablesen, dass das Nuklid unten rechts mit der Notation 247Cm ein Curium-Isotop mit Massenzahl 247 ist. Es hat 96 Protonen und 151 Neutronen. Die Farbe in dieser Nuklidkarte gibt die Halbwertszeit der Nuklide an. Grau unterlegte Nuklide leben kürzer als eine Stunde, Blaue kürzer als einen Tag dunkelgrüne einen bis sechzig Tage und so geht es weiter über hellgrün, gelb und orange zu den roten Nukliden, deren Halbwertszeiten größer als 10 Millionen Jahre aber kürzer als 50 Millionen Jahre ist.
Die in diesem Ausschnitt braun gefärbten Nuklide, Thorium-232, Uran-235, Uran-238 und Pu-244 bezeichnet man als primordiale Nuklide. Ihre Halbwertszeiten liegen über 50 Millionen Jahre. Das ist so lange, dass sie seit Entstehung der Erde vor etwa 4,6 Milliarden Jahren noch nicht vollständig zerfallen sind. Man findet diese Nuklide also noch in natürlich vorkommenden Gesteinen. Uran-238 hat zum Beispiel eine Halbwertszeit von 4,5 Milliarden Jahren. Von den Uran-238 Nukleonen, die bei Entstehung der Erde existierten ist also erst die Hälfte zerfallen. Thorium-232 lebt sogar 14 Milliarden Jahre.
Befasst man sich näher mit Kernphysik, so wird schnell klar wozu es nötig ist Nuklide und nicht Elemente zu unterscheiden: Nehmen wir als Beispiel die beiden braun markierten, also promordialen Nuklide Uran-235 und Uran-238, die in der Nuklidkarte untereinanderstehen. Sie tauchen im Periodensystem der Elemente gemeinsam in der Reihe der Actiniden unter dem Namen Uran auf. Aus der Sicht der Atomphysik ist das gerechtfertigt. Chemisch macht es keinen wesentlichen Unterschied, ob der Kern 235 oder 238 Einheiten schwer ist. Kernphysikalisch ist es aber entscheidend, denn Uran-235 zerfällt mit einer Halbwertszeit von "nur" 700 Millionen Jahren etwas schneller als Uran-238 und kann erheblich leichter zur künstlichen Kernspaltung angeregt werden. Das ist der Grund, warum Uran-235, das weniger als 1% des natürlichen Uranvorkommens ausmacht, für die Nutzung der Kernenergie so viel bedeutender ist als Uran-238.
©1999-2025 Joachim Schulz - Nur echt auf www.Quantenwelt.de
Letzte Änderung: 15.01.2011