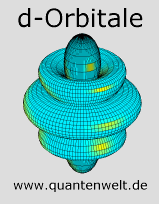
Orbitale mit zwei Drehimpulsquanten nennt man d-Orbitale. Man kann d-Orbitale in fünf Klassen einteilen. Wie schon bei den p-Orbitalen, gibt es auch hier verschiedene Einteilungsmöglichkeiten. Rechts im Bild ist die in der Atomphysik gebräuchliche Einteilung nach den magnetischen Quantenzahlen von -2 bis +2 zu sehen. Eine weitere Einteilung orientiert sich eher an den Raumachsen. Diese ist in der Chemie gebräuchlicher, ich stelle sie auf der Seite über d-Orbitale nach räumlicher Ausrichtung dar.
Das erste d-Orbital gehört zur dritten Hauptschale und wird im chemischen Element Scandium zum ersten Mal besetzt. Die Elemente, bei denen das äußerste Elektron in einem d-Orbital ist, nennt mann Übergangsmetalle (siehe: Periodensystem der Elemente). Wichtige Metalle wie Chrom, Eisen und Gold gehören zu den Übergangsmetallen.

Links im Bild ist das d-Orbital mit magnetischer Quantenzahl m=0 zu erkennen. Wie schon im entsprechenden p-Orbital sind die Elektronen dieses Orbitals nahe an der Hauptachse konzentriert. Das Orbital ist noch "schlanker" als das p-Orbital (siehe: Vergleich der keulenförmigen Orbitale). Zusätzlich gibt es einen ringförmigen Bereich mit einer geringeren Elektronendichte um das Zentrum herum.

Das rechte Bild zeigt das d-Orbital mit magnetischer Quantenzahl m=±1. Die Elektronen halten sich bevorzugt in zwei Ringen um die Achse herum auf. Es gibt zwei dieser Orbitale, die sich voneinander in der Umlaufrichtung der Elektronen unterscheiden, sonst aber identisch aussehen. Da jedes Orbitals mit bis zu drei Elektronen besetzt ist, nehmen also bis zu vier Elektronen den gleichen Raum ein. Die widerspricht nicht dem Pauli-Prinzip, da sich je zwei der vier Elektronen in Spin und/oder Umlaufrichtung unterscheiden.

Das d-Orbital mit magnetischer Quantenzahl m=±2 ist im Bild links dargestellt. Dieses Orbital bildet einen Ring um den Atomkern es unterscheidet sich von dem entsprechenden p-Orbital darin, dass der Ring flacher ist (siehe: Vergleich der ringförmigen Orbitale). Auch dieses Orbital gibt es mit zwei verschiedenen Umlaufrichtungen der Elektronen.
d-Orbitale nach räumlicher Ausrichtung
d-Orbitale nach magnetischen Quantenzahlen
Vergleich der ringförmigen Orbitale
Vergleich der keulenförmigen Orbitale
Bewegen sich die Elektronen im Orbital?
Woher haben die Orbitale ihre Bezeichnungen?
©1999-2025 Joachim Schulz - Nur echt auf www.Quantenwelt.de
Letzte Änderung: 27.03.2004