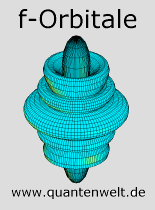
Orbitale mit drei Drehimpulsquanten nennt man f-Orbitale, hiervon gibt es sieben. Da jedes Orbital mit zwei Elektronen besetzt werden kann, gibt es 14 f-Elektronen. f-Orbitale gibt es ab der 4. Hautschale, sie werden aber erst nach den s-Orbitalen der 6. Hauptschale im Element Lanthan zum ersten Mal besetzt (siehe: Periodensystem der Elemente). Elemente, in denen die f-Orbitale unvollständig gefüllt sind, nennt man Lanthanoide für die 4f-Schale und Actinoide für die 5f-Schale. Die Lanthanoide gehören zu den seltenen Erden.
Wie auch bei den p- und d-Orbitalen gibt es verschiedene Möglichkeiten sie einzuteilen. Die häufigste Einteilung geschieht nach magnetischen Quantenzahlen, man kann aber auch eine räumliche Einteilung der f-Orbitale vornehmen.

Links im Bild ist die Elektronenverteilung des f-Orbitals mit magnetischer Quantenzahl m=0 abgebildet. Elektronen in diesem Orbital erzeugen also kein Magnetfeld. Das Orbital hat, wie alle Orbitale ohne Magnetfeld, die Form einer Doppelkeule um die Hauptachse herum. Das Orbital ist noch schlanker als das entsprechende p- und d-Orbital (siehe: Vergleich der keulenförmigen Orbitale). Zusätzlich zu der Doppelkeule gibt es noch zwei ringförmige Bereiche um den Atomkern herum, in denen die Elektronen mit einer geringeren Wahrscheinlichkeit zu finden sind.
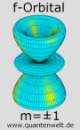
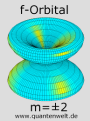
Die beiden Bilder links und rechts von diesem Absatz zeigen die f-Orbitale mit magnetischer Quantenzahl m=±1 (links) und m=±2 (rechts). Sie bestehen je aus zwei Ringen ober- und unterhalb der Kernebene, wobei das Orbital links im Bild noch einen dritten Ring in dieser Achse besitzt. Man kann hier die allgemeine Regel beobachten, dass ein Orbital aus um so mehr getrennten Bereichen besteht je kleiner die magnetische Quantenzahl im Vergleich zur Drehimpuls-Quantenzahl ist. Das m=±1 Orbital hat drei solcher Bereiche während die Doppelkeule oben mit ihren beiden kleinen Ringen vier Bereiche aufweist und das m=±2 Orbital (rechts) nur zwei.

Das f-Orbital mit magnetischer Quantenzahl m=±3 (links im Bild) besteht aus nur einem Bereich. Es hat die Form eines Ringes um den Kern. Dieser Ring ist flacher, als der des p- und d-Orbitals (siehe: Vergleich der ringförmigen Orbitale).
Von allen hier gezeigten Orbitalen außer der Doppelkeule gibt es zwei Varianten, die sich nur durch die Umlaufrichtung des enthaltenen Elektrons unterscheiden. Dadurch bekommt man die Gesamtzahl von 7 dieser Orbitale. Da jedes Orbital nach dem Pauli-Prinzip zwei Elektronen mit unterschiedlichem Spin aufnehmen kann, können 14 Elektronen in f-Orbitalen untergebracht werden. Es gibt also je 14 Actinoide und Lanthanoide.
f-Orbitale nach räumlicher Ausrichtung
f-Orbitale nach magnetischen Quantenzahlen
Vergleich der ringförmigen Orbitale
Vergleich der keulenförmigen Orbitale
Bewegen sich die Elektronen im Orbital?
Woher haben die Orbitale ihre Bezeichnungen?
©1999-2025 Joachim Schulz - Nur echt auf www.Quantenwelt.de
Letzte Änderung: 28.03.2004